Índice
- 1 Qué es un biofilm: biopelícula en heridas
- 2 Cómo se forma el biofilm o la biopelícula en heridas
- 3 Biopelícula en heridas: un factor que retrasa la curación
- 4 Cómo distinguir la biopelícula del esfacelo
- 5 La biopelícula está en constante cambio
- 6 Desbridamiento para el manejo de la biopelícula en heridas
- 7 ¡Escríbenos y síguenos en nuestras redes sociales!
- 8 Fuentes de consulta:
Qué es un biofilm: biopelícula en heridas
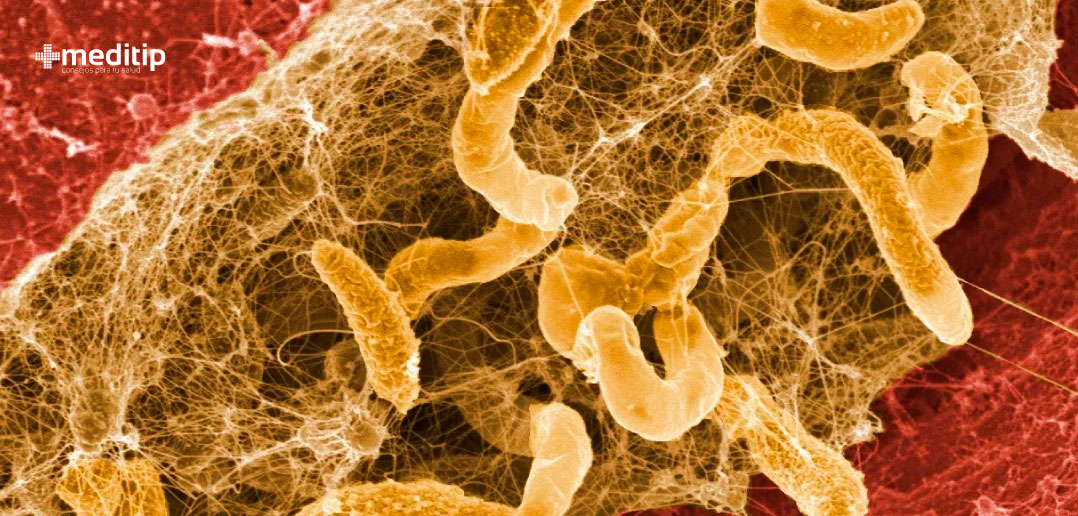
El manejo adecuado de las heridas a través de una valoración oportuna y un cuidado local adecuado, puede ahorrar muchas complicaciones. Tratar de la manera correcta una herida, puede evitar que se forme un biofilm o biopelícula. Las biopelículas son comunidades microbianas complejas que no se perciben a simple vista y que contienen bacterias y hongos. Estos microorganismos sintetizan y segregan una matriz protectora que adhiere firmemente la biopelícula a una superficie viva o no viva. La biopelícula en heridas por lo general conduce a una cicatrización tardía. Esto ocurre con mucha más frecuencia de lo que se piensa.
Una biopelícula es una comunidad dinámica heterogénea que cambia continuamente. Dependiendo de la herida, una biopelícula puede consistir en una sola especie bacteriana o fúngica. También puede ser polimicrobiana, es decir, contener múltiples especies de microorganismos. En resumen, la biopelícula puede describirse como microorganismos incrustados en una barrera espesa y viscosa de azúcares y proteínas.
El biofilm se puede formar en la superficie de dispositivos médicos. Por ejemplo, catéteres, tubos endotraqueales, implantes ortopédicos y mamarios, dispositivos intrauterinos, suturas, etcétera. La biopelícula es un importante contribuyente de enfermedades que se caracterizan por una infección bacteriana e inflamación crónica. Esto incluye la enfermedad periodontal, fibrosis quística, acné crónico y osteomielitis.
La biopelícula en heridas también es común. Se cree que el crecimiento de biofilm es el motivo de retraso en la curación de varias heridas. Una herida crónica es una herida que se estanca en la fase inflamatoria de la cicatrización. Es decir, no avanza hacia la epitelización o regeneración del tejido.
Debido a que el biofilm es un factor importante que contribuye a múltiples enfermedades inflamatorias crónicas, es probable que casi todas las heridas crónicas tengan una biopelícula, al menos en parte del lecho de la herida.
Cómo se forma el biofilm o la biopelícula en heridas
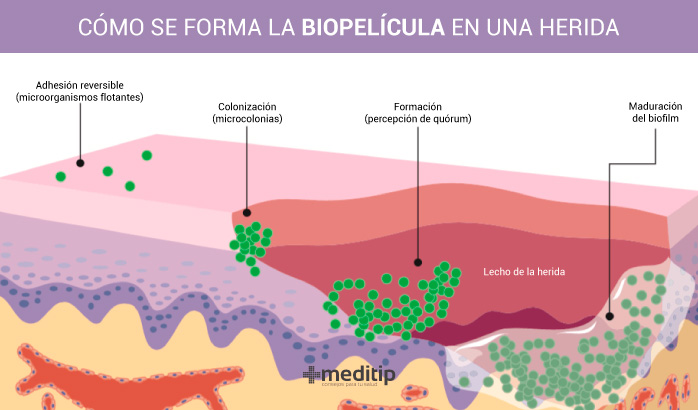
La formación de biofilm en una herida se produce a través de una serie de procesos que son potencialmente reversibles en las primeras etapas de la colonización microbiana. Sin embargo, a medida que avanza la formación de biopelícula, la interrupción y la eliminación se vuelven cada vez más difíciles. Esto se debe en parte, a que los microorganismos planctónicos (flotación libre) y las colonias microbianas que forman el biofilm se comportan de manera diferente. Las etapas de la formación de la biopelícula en heridas son:
Etapa uno: adhesión reversible
Los microorganismos se perciben como flotantes y solitarios, es decir, planctónicos. Sin embargo, en condiciones naturales, la mayoría de los microorganismos tienden a adherirse a las superficies y eventualmente formar una biopelícula. En esta etapa inicial, la adhesión es reversible. Un profesional de la salud puede revertir con relativa facilidad el desarrollo de biofilm en la herida mediante la limpieza y el desbridamiento.
Solicita una consulta de valoración y conoce las diversas opciones para el tratamiento de heridas, clic aquí
Etapa dos: adhesión permanente o irreversible
A medida que las bacterias se multiplican, se adhieren con mayor firmeza a la herida (sésiles). Además, se diferencian cambiando los patrones de expresión génica de formas que promueven su supervivencia. Este suele ser el resultado de un tipo de comunicación bacteriana conocida como percepción de quórum. Posteriormente, se empieza a formar microcolonias.
Etapa tres: matriz protectora / biopelícula viscosa
La etapa tres de formación de biopelícula en heridas consiste en que una vez que las bacterias están firmemente unidas, comienzan a segregar una matriz circundante o conglomerado conocido como sustancias poliméricas extracelulares (EPS, por sus siglas en inglés). Las pequeñas colonias bacterianas posteriormente forman una biopelícula inicial. Como resultado, las microcolonias se vuelven cada vez más tolerantes a los biocidas. Es decir, antibióticos, antisépticos y desinfectantes. La secreción de diversas proteínas y enzimas facilita que el biofilm se incruste firmemente en el lecho de la herida.
La composición exacta de las sustancias poliméricas extracelulares varía según los microorganismos presentes. Aunque por lo general, consiste en polisacáridos, proteínas, glicolípidos y ADN bacteriano. Se cree que el ADN bacteriano liberado por bacterias vivas o muertas proporciona un componente estructural importante para la matriz de biopelículas en heridas.
El biofilm completamente maduro elimina continuamente las bacterias planctónicas, las microcolonias y los fragmentos de biopelículas. Estas pueden dispersarse y unirse a otras partes del lecho de la herida o a otras heridas, formando nuevas colonias de biopelículas.
Etapa cuatro: aumento de la tolerancia a los biocidas
Sin interrupciones, las microcolonias integradas evolucionarán a colonias de biopelículas completamente maduras que son resistentes a los biocidas. Esto puede conducir a un mayor desarrollo de biopelículas en un plazo de dos a cuatro días, dependiendo de la especie y las condiciones de crecimiento.
Reformación: una ventana de oportunidad
La maduración de la biopelícula puede ocurrir en 24 a 72 horas. En este momento, un desbridamiento (quirúrgico o biológico, por ejemplo) podría proporcionar una breve oportunidad. Es decir, al desbridar, los tratamientos antimicrobianos son más efectivos para reducir tanto los microorganismos planctónicos, como los de biopelícula en heridas.
Biopelícula en heridas: un factor que retrasa la curación
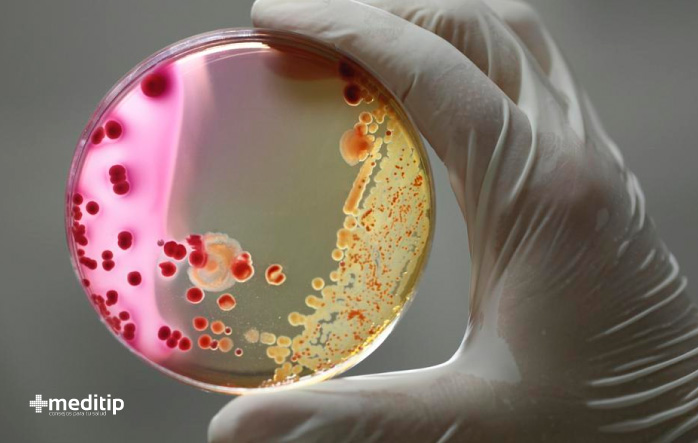
Es relativamente reciente el conocimiento sobre que el biofilm o biopelícula es un factor que puede contribuir a retrasar la curación de heridas. Las heridas crónicas a menudo carecen de signos clínicos evidentes de infección. Además, con frecuencia presentan una carga bacteriana baja, según lo determinan los ensayos clínicos estándar de laboratorios de microbiología clínica. Sin embargo, las pruebas estándar de microbiología están optimizadas para cultivar bacterias planctónicas. En otras palabras, no miden adecuadamente las bacterias de biopelículas, las cuales requieren técnicas de cultivo especiales.
El término colonización crítica se desarrolló en un intento de reconocer que las bacterias desempeñan un papel crítico en el retraso de la curación en heridas que no tienen una infección evidente. En realidad, el concepto de colonización crítica o infección localizada, probablemente describe la presencia de una biopelícula en una herida crónica.
Aquí encontrarás productos para el cuidado y tratamiento de heridas
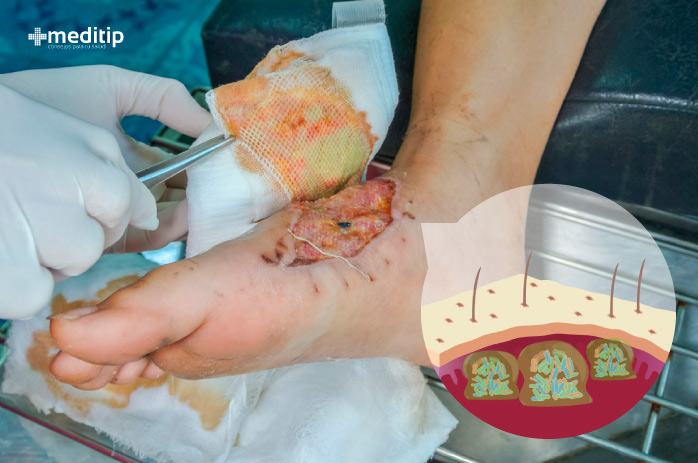
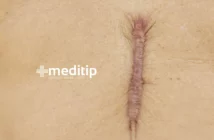
Cómo distinguir la biopelícula del esfacelo
El esfacelo se puede describir como una capa viscosa, amarilla y relativamente opaca en el lecho de la herida. Mientras que el biofilm o la biopelícula en heridas puede tener apariencia similar a un gel brillante. No obstante, puede haber un vínculo entre el biofilm y el esfacelo. Las biopelículas estimulan la inflamación. Esto a su vez aumenta la permeabilidad vascular, la producción de exudado y la acumulación de fibrina. Por lo tanto, el esfacelo puede indicar la presencia de biopelícula en una herida. Actualmente, el método más confiable para confirmar la presencia de biopelícula es la microscopía especializada. En específico, la microscopía confocal láser de barrido.
La biopelícula está en constante cambio
La investigación internacional ha identificado algunas características clave de las biopelículas. Por ejemplo, no son solo una cubierta, sino que penetran profundamente en el lecho de la herida. Además, muchas bacterias diferentes se unen, así como hongos y varios otros microorganismos. Por lo tanto, cada biofilm es diferente y cada uno está cambiando constantemente.
Otra característica especial es que la resistencia a los antibióticos de las bacterias incrustadas en esta matriz protectora puede ser hasta mil veces mayor que la de los patógenos individuales. Incluso si un tratamiento es exitoso, los microbios sobrevivientes pueden reconstruir la biopelícula en heridas en 24 horas.
Sin embargo, un biofilm que es impenetrable, no sobrevive mucho en condiciones de laboratorio. Debido a las limitaciones que acompañan a la placa de Petri, el significado o relevancia del biofilm en las heridas crónicas se ha subestimado durante mucho tiempo.
Las biopelículas en el laboratorio pueden reaccionar a las moléculas que atacan la matriz. Pero con los pacientes, las cosas pueden verse muy diferentes. De acuerdo con el investigador de biopelículas Thomas Bjarnsholt, en primer lugar, debemos entender qué procesos tienen lugar en las heridas crónicas para entonces desarrollar nuevos ingredientes activos. Las heridas crónicas se toman más en serio que antes. Ahora se sabe que si una herida no cierra después de tres meses, las posibilidades de curación disminuyen significativamente.
Finalmente, uno de los enfoques más importantes para el manejo de la biopelícula en heridas es la destrucción de la matriz protectora. Se cree que la clave podrían ser las lectinas. Estas proteínas permiten la unión de las bacterias. Sin una función adherente de las lectinas, una biopelícula pierde su soporte y se desmorona. De esta forma, las bacterias son nuevamente accesibles para ser combatidas por el sistema inmunológico y los antibióticos.
Puedes leer también: La Miel de Grado Médico: ¿Qué Es y Cuáles Son Sus Usos?
Desbridamiento para el manejo de la biopelícula en heridas
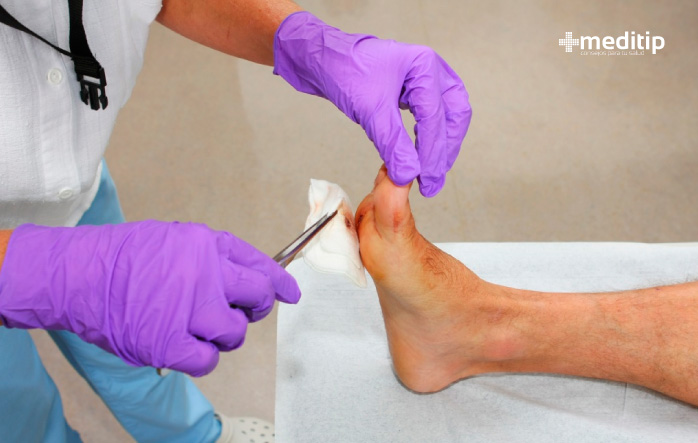
Hasta que el enfoque terapéutico mencionado arriba esté listo para el mercado, actualmente la mejor opción para combatir la biopelícula en heridas es el desbridamiento. Este término se refiere a la eliminación de esfacelo, tejido muerto o tejido no viable y contaminado de una herida.
De todos los tipos de desbridamiento, la opción más rápida es el desbridamiento quirúrgico. Sin embargo, en este procedimiento existe el riesgo de que parte del tejido sano también se dañe. Esto a su vez puede prolongar la curación.
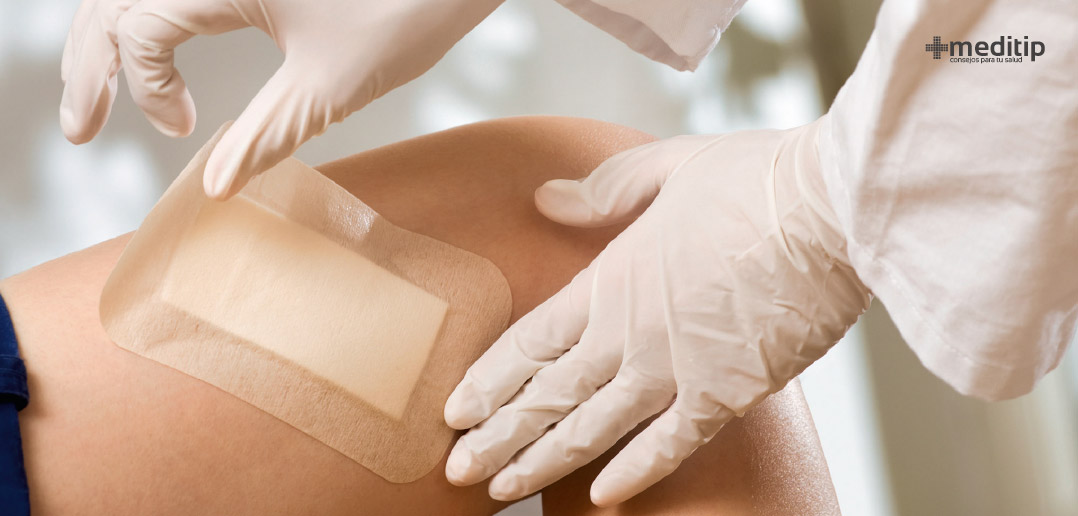
La elección del método de desbridamiento depende del estado de la herida y de otros factores. Después del desbridamiento, la herida limpia se trata localmente con apósitos especializados que contienen sustancias antimicrobianas, como plata, yodo o ácidos orgánicos.
Es especialmente relevante que los apósitos con plata pueden ayudar a reducir significativamente la carga bacteriana de la herida. El cambio de apósito depende de diversos factores, por ejemplo, la cantidad de exudado. El mecanismo de acción de los apósitos con plata es que a través de la absorción del exudado, se produce un intercambio de iones y se forma un gel. Durante este proceso, se liberan iones de plata que pueden matar las bacterias.
Es fundamental que los profesionales de la salud reconozcan en etapa temprana la biopelícula y se limpie el área de manera efectiva. Aunque es difícil de ver, puede haber indicios de que se está formando una biopelícula. Por ejemplo, si el progreso de la herida se ha estancado durante semanas, puede indicar que una colonia de bacterias se ha formado. Al estar informado y seguir las mejores prácticas actuales, los profesionales de la salud podrán ayudar a reducir el riesgo de retraso en la curación y mejorar los resultados de los pacientes.
Nuestro objetivo en Meditip es informarte y ayudarte a tomar las mejores decisiones acerca de lo más valioso que tienes: tu salud y la de tus seres queridos. Hacemos un gran esfuerzo por presentar información de manera sencilla y fácil de entender. Síguenos por redes sociales y haznos saber si estamos haciendo bien nuestro trabajo. También puedes sugerirnos temas de salud de los que te gustaría aprender más.
Fuentes de consulta:
Phillips PL, Wolcott RD, Fletcher J, Schultz GS. (2010). Biofilms made easy. 24 de julio de 2019, de Wounds International Sitio web: https://www.woundsinternational.com/uploads/resources/6e7fffcdeef76d9d3e652be2854315a6.pdf
Hygiene in practice. (2016). The biofilm mystery – Why do wounds fail to heal? 24 de julio de 2019, de Hygiene in practice Sitio web: https://www.hygiene-in-practice.com/the-biofilm-mystery-why-do-wounds-fail-to-heal/
Christopher Attinger y Randy Wolcott. (2012). Clinically Addressing Biofilm in Chronic Wounds. 24 de julio de 2019, de Advances in Wound Care Sitio web: https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3839004/
Bjarnsholt T et al. (2017). Management of wound biofilm. 24 de julio de 2019, de Wounds International
Cathy Thomas Hess y Robert S. Kirsner. (2012). Understanding the Presence of Biofilms in Wound Healing: Opportunities for Intervention. 24 de julio de 2019, de Today’s Wound Clinic Sitio web: https://www.todayswoundclinic.com/understanding-presence-biofilms-wound-healing-opportunities-intervention
Daniel Metcalf, Philip Bowler y David Parsons. (2016). Wound Biofilm and Therapeutic Strategies. 24 de julio de 2019, de IntechOpen Sitio web: https://www.intechopen.com/books/microbial-biofilms-importance-and-applications/wound-biofilm-and-therapeutic-strategies
Wound Source. (2018). What Are Biofilms?. 24 de julio de 2019, de Wound Source Sitio web: https://www.woundsource.com/blog/what-are-biofilms




3 comentarios
Pingback: TIME: principios de la preparación del lecho de la herida
Pingback: Apósitos para heridas infectadas - Mölnlycke
Pingback: Cómo usar Mepilex® Ag - Mölnlycke